Estados de la materia |
La materia se presenta en tres estados o formas de agregación: sólido, líquido y gaseoso.
Dadas las condiciones existentes en la superficie terrestre, sólo algunas sustancias pueden hallarse de modo natural en los tres estados, tal es el caso del agua.
La mayoría de sustancias se presentan en un estado concreto. Así, los metales o las sustancias que constituyen los minerales se encuentran en estado sólido y el oxígeno o el CO2 en estado gaseoso:
- Los sólidos: Tienen forma y volumen constantes. Se caracterizan por la rigidez y regularidad de sus estructuras.
- Los líquidos: No tienen forma fija pero sí volumen. La variabilidad de forma y el presentar unas propiedades muy específicas son características de los líquidos.Fluyen y son poco compresibles
- Los gases: No tienen forma ni volumen fijos. En ellos es muy característica la gran variación de volumen que experimentan al cambiar las condiciones de temperatura y presión.Fluyen y son compresibles
Cambios de estado
Se acepta el modelo atomico-molecular elemental para explicar los estados de agragación y sus cambiosLa figura siguiente muestra los tres estados y los cambios entre ellos:
Si observamos las figuras sólido , líquido y gas , vemos que están formadas por particulas (átomos o moléculas ) que el sólido ocupan posiciones fijas y se muestran fuertemente unidas; en el líquido están juntas pero tienen libertad de moverse entre ellas y de adaptarse al recipiente que lo contiene (imagine la arena muy fina de la playa) y por último el gas cuyas particulas están practicamente desligadas entre si y se mueven a gran velocidad dentro del espacio disponible (que ocupan totalmente) pareciendo que las particulas estan en todas partes como parece que un ventilador girando es continuo.
Dar energía térmica a un sólido agita sus particulas llegando a debilitar las uniones entre ellas y a determinada temperatura propia de la sustancia pasa a líquido , este a su vez por el calor suficiente se rompe por debilitarse la unión entre sus particulas pasando así a gas
La temperatura es la medida de la energía térmica de un cuerpo y su medida se realiza mediante termometro Determinadas sustancias pasan directamente de sólido a gas i a la inversa , son ejemplos el yodo y naftalina
Todos los cambios de estado dependen de la sustancia , temperatura y de la presión que experimentan aquella. Ejemplos :
a) El agua a 1atm (760mmHg) funde a 0ºC y hierve a 100ºC, pero esto no es así a presiones disitntas a 1 atm como se puede ver en la gráfica siguiente
Si lee la gráfica a 200mmHg de presión el agua herviria a ~65ºC
b) a presiones mayores a 760mmHg , en una olla a presión el agua hierve 120ºC , es decir si P aumenta la temperatura de ebullición (temperatura de hervor) aumenta
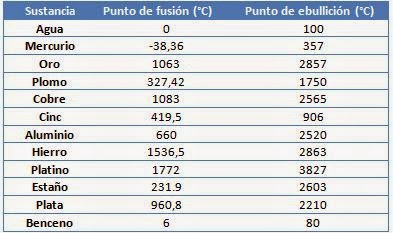
c) Respecto a las sustancias a 1atm de presión es ilustrativa la siguiente tabla
que indica que el punto de fusión( temperatura de fusión) y el punto de ebullición(temperatura a la que el líquido hierve) son propiedades específicas de las sustancias
d) En la gráfica (ºC versus tiempo) siguiente se ve un calentamiento del agua , desde el estado sólido al estado gas
A partir de esta gráfica experimental se deducen los siguientes hechos:
i-Al aumentar la T calentamos el sólido y llegamos a una T=0ºC donde el agua sólida se transforma en agua líquida y esta temperatura se mantiene constante mientras convivan los dos estados (s-l) ; cuando desaparece el sólido ( porqué se ha convertido todo en líquido) la temperatura aumenta en el líquido mientras haya una fuente de calor que actue sobre el líquido, cuando se llega a T=100ºC el agua líquida se comienza a convertir en agua gas y esta temperatura se mantiene constante mientras convivan los dos estados (l-g); cuando desaparece el líquido por haber pasado todo a gas, la temperatura del agua gas aumenta mientras haya una fuente de calor que actue sobre el gas.
e)La gráfica T-P del agua (diagrama de fases del agua) nos dice a que temperatura y presión el agua sólida sublima directamente , es decir pasa de S a G sin pasar por L. Esto tiene la utilidad de secar absolutamente alimentos sin romper la estructura del alimento y el proceso de secado se llama liofilización , son productos liofilizados los alimentos de sobre : sopas , zumos... que se restituyen añadiendo agua
a la presión P la T1 es la temperatura de fusión y la T2 es la temperatura de ebullición .Si fuera P= 760mmHg T1=0ºC y T2=100ºC
f) sublimación del yodo
video MOLÉCULAS y cambios de estado PASO A PASO
Conceptos básicos:
1-Los estados de agregación y sus propiedades2-Cambios de estado y sus propiedades
3-Dependencia de las temperaturas de fusión , ebullición (vaporización) y sublimación de la naturaleza de las sustancias y de la presión
4-Evaporación: conversión superficial de líquido a gas a cualquier temperatura
; es mayor cuanto mayor es la volatilidad de la sustancia ( alcohol más volatil que el agua y menos que la acetona),cuanto mayor es la temperatura ambiente, cuanto mayor es la superficie expuesta del liquido y cuanto menor es la presión del ambiente ( la presion es menor cuanto mas viento hace) [ aplicación : secar la ropa por extensión de esta en un tendedero]
Para ver mas y ejercicios pincha aquí




No hay comentarios:
Publicar un comentario